氡
body.skin-minerva .mw-parser-output table.infobox captiontext-align:center
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
無色氣體 氡的光譜線 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 氡(Radon)·Rn·86 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 稀有氣體 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 18 ·6·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | (222) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [Xe] 4f14 5d10 6s2 6p6  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 弗里德里希·恩斯特·道恩(1898年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 威廉·拉姆齊和羅伯特·懷特洛-格雷(1910年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 氣體 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (0 °C, 101.325 kPa) 9.73 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
沸點時液體密度 | 4.4 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 202 K,−71 °C,−96 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 211.5 K,−61.7 °C,−79.1 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 臨界點 | 377 K,6.28[1] MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 3.247 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 18.10 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 5R/2 = 20.786 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 6, 2, 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.2(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:1037 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 220 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 面心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 無磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 3.61×10−3 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 10043-92-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:氡的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
氡是化學元素,符號為Rn,原子序為86,屬於稀有氣體,無色、無臭、無味,具放射性[2],是鐳自然衰變後的間接產物,最穩定同位素為222Rn,半衰期為3.8天。在常規條件下,氡是密度最高的氣體物質之一。它同時也是唯一一種常規條件下只含放射性同位素的氣體,其輻射可以對健康造成損害。由於其放射性很強,所以針對氡的化學研究較為困難,已知化合物也很少。
釷和鈾在地球形成時已經存在。在它們緩慢衰變為鉛的過程中,氡會作為衰變鏈的一部份自然產生。釷和鈾的自然同位素半衰期都長達數十億年,因此這兩種元素連同鐳、氡等衰變產物,在今後幾千萬年後的豐度仍將和今天的程度相近。[3]當氡氣衰變時,其衰變產物不再是氣體,而是固體物質,並且會粘附在各種表面上,例如空氣塵粒。如果這種塵粒進入呼吸管道,會附在肺部氣道中,增加患上肺癌的機會。[4]
與所有母同位素不同的是,氡是一種氣體,可輕易吸入體內。自然氡氣也因此是公眾所受到的電離輻射的主要來源,也是一般背景輻射的單一最大源頭。氡氣濃度在不同地點的濃度可以有巨大的差異。雖然壽命較短,但自然氡氣能在建築物中積累到遠高於正常的程度,特別是下沉至地下室和地勢較低的窄小空間中。一些泉水和溫泉也會釋放氡氣。[5]
氡是一種重要的室內空氣污染物。根據美國國家環境保護局,氡是繼吸煙後的最大肺癌成因,每年在美國導致21,000人死亡,其中約2,900人從未吸過煙。根據估計,在非吸煙者群體中,氡是首位肺癌成因。[6]
目录
1 性質
1.1 物理性質
1.2 化學性質
1.3 同位素
1.3.1 衰變產物
2 歷史及命名
3 存量
3.1 濃度單位
3.2 自然產生
3.3 室內累積
3.4 工業生產
3.5 濃度表
3.6 累积剂量
4 應用
4.1 醫學
4.2 科學研究
5 健康危害
5.1 礦井
5.2 家居暴露水平
5.3 行動水平及參考水平
5.4 與吸煙的關係
5.5 與二手煙的關係
5.6 食水
5.7 測試及預防
6 參考資料
7 外部連結
性質

氡的發射光譜,1908年歐內斯特·盧瑟福攝。光譜旁的數字為波長。中間為氡的光譜,外面兩個則是氦的光譜以作校準。
物理性質
氡氣無色、無臭、無味,單靠人類感官無法探測。在標準溫度和壓力下,氡是一種單原子氣體,密度為9.73 kg/m3,[7]約為海平面地球大氣密度(1.217 kg/m3)的8倍。[8]氡是密度最高的稀有氣體,也是室溫下密度最高的氣體之一。雖然在標準溫度和壓力下無色,但它在冷卻至冰點202 K以下後會因放射性發光,隨溫度降低而從黃色漸變為橘紅色。[9]在凝結之後,氡同樣會因放射性發光。[10]氡略溶於水,其可溶性相對比它輕的稀有氣體高。氡在有機化合物液體中的可溶性比在水中高得多。[11]
化學性質
氡屬於一類價電子層已滿的元素,這些元素統稱為稀有氣體。由於其擁有8個外層價電子,所以它對於燃燒反應等多數常見化學反應都呈惰性。這種電子排布會形成穩定的低能組態,此時外層電子緊緊束縛在原子中。[12]其第一電離能(即移除一顆電子所需的最低能量)為1037 kJ/mol。[13]但根據元素週期表的趨勢,氡的電負性比之上的元素氙要低,所以化學活性會比氙高。早期研究發現,水合氡的穩定程度應該與氯(Cl2)和二氧化硫(SO2)的水合物相當,且明顯比硫化氫(H2S)的水合物高。[14]
由於價格高、放射性強,所以科學家不常進行氡的化學研究。已知的氡化合物很少,都屬於氟化物或氧化物。氡可以被氟等強氧化劑氧化,形成揮發性低的二氟化氡。[15][16]在250 °C以上溫度,二氟化氡會分解成其组成元素的单质形态。由於氡壽命之短和放射性之強,研究未能確定該化合物的具體屬性。理論性研究則預測,二氟化氡分子中的氡-氟鍵長為2.08 Å,且它的熱力學穩定性比同系物二氟化氙(XeF2)更高,揮發性更低。[17]另一種氟化物RnF6的分子結構為八面體型,其生成焓預計將比二氟化氡更低。[18]有研究稱RnF4和RnF6等較高氟化物是存在的,[19]而且根據計算它們都是穩定化合物,[20]但一些化學家則懷疑這項研究的結論。[19][RnF]+離子的形成反應式相信為:[21]
- Rn (g) + 2 [O2]+[SbF6]− (s) → [RnF]+[Sb2F11]− (s) + 2 O2 (g)
其他可能存在的氡化合物還包括氧化氡,[22]其中只有三氧化氡已經確認存在。[19]根據預測,羰基氡(RnCO)是一種具有直線形分子構型的穩定化合物。[23]根據計算,Rn2和RnXe分子的穩定性因自旋-軌道作用而大大提高。[24]有科學家提出把氡包在富勒烯分子中,作為治療腫瘤的一種藥物。[25]雖然氙可以形成Xe(VIII),但氡卻沒有發現能夠形成Rn(VIII)化合物。就算存在,RnF8的化學穩定性也會非常低(XeF8為熱力學不穩定化合物)。最穩定的Rn(VIII)化合物預計會是高氡酸鋇(Ba2RnO6),類似於高氙酸鋇。[20]
同位素

鐳衰變系,亦稱鈾衰變系。
氡沒有穩定同位素,已知放射性同位素共有36種,其原子量在193和228之間。[26]最穩定的同位素是222Rn,它是226Ra的衰變產物,而226Ra則是238U的衰變產物。[27]
除此之外半衰期超過一小時的同位素還有三種:211Rn、210Rn和224Rn。其中220Rn是釷的最穩定同位素232Th的自然衰變產物,通常稱為「thoron」。它會釋放α粒子,半衰期為55.6秒。219Rn則是錒的最穩定同位素227Ac的產物,可稱「actinon」。它同樣釋放α粒子,半衰期為3.96秒。[26]
衰變產物
222Rn是鐳和鈾-238的衰變系成員之一,其半衰期為3.8235天。它的主要衰變途徑會產生四種壽命很短的產物,所以通過測量產物的瓦解,可以得知最初氡的分佈情況。其衰變鏈如下表從上至下:[26]
| 同位素 | 半衰期 | 衰變途徑 | 或者 |
|---|---|---|---|
222Rn | 3.8天 | α衰變 | |
218Po | 3.10分鐘 | α衰變 | β→218At→α |
214Pb | 26.8分鐘 | β衰變 | |
214Bi | 19.9分鐘 | β衰變 | α→210Tl→ |
214Po | 0.1643毫秒 | α衰變 | |
210Pb | 22.3年 | β衰變 | |
210Bi | 5.013天 | β衰變 | |
210Po | 138.376天 | α衰變 | |
206Pb | 穩定 | ||
在一個持續充斥著氡的密閉空間內,短壽命子同位素的濃度會不斷增加,直到每種子同位素的衰變率都和氡相同為止,也就是達致平衡。氡平衡因子[28]指的是某一時刻這些短壽命子同位素的放射性(對生物影響的主要因素)佔平衡時子同位素總放射性的比例。平衡時,此因子等於1,這意味著衰變產物在氡母同位素的附近存留了足夠長的時間(一般為數小時),使兩者的放射性達成了平衡。此時每增加1 pCi/L的氡,都會使暴露量提高0.01 WL(WL為採礦業常用的輻射單位,定義請見下)。平衡條件並不會經常滿足,實際上在大多數家中,平衡因子一般在40%的水平。換言之,空氣中每pCi/L的氡都會有0.004 WL的衰變產物。[29]
氡的子同位素會因靜電荷而吸附在塵粒上,而氡氣本身則不會。塵埃粘附在牆壁和傢具上,便會把子同位素從空氣中移除,這一般會使空氣的平衡因子低於1。空氣的流通以及過濾系統都會降低因子,相反空氣粉塵則會提高因子,這包括香煙所產生的煙霧。空氣中高濃度的氡相關同位素會大大提高對人類健康的威脅。流行病學研究文獻中所列出的氡平衡因子是0.4。[30]
歷史及命名
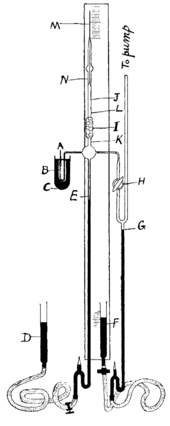
拉姆齊和懷特洛-格雷用於分離氡的器具。M是一根毛細管,它總共分離出約0.1 mm3的氡氣。氡和氫(H2)的混合物經虹吸管A進入真空系統。水銀以黑色表示。
弗里德里希·恩斯特·道恩在1900年發現了氡元素。當時氡是繼鈾、釷、鐳和釙之後第五個被發現的放射性元素。[31][32][33][34][35][36]道恩發現在一些試驗中,鐳化合物會散發一種放射性氣體。他將其稱為「鐳射氣」(Radium Emanation,簡稱Ra Em)。[37]1899年,皮埃爾和瑪莉·居禮曾觀察到鐳所發出的氣體在一個月後仍保持其放射性。[38]同年,蒙特利爾麥吉爾大學的羅伯特·B·歐文斯(Robert B. Owens)和歐内斯特·盧瑟福在測量來自氧化釷的輻射時,注意到了輻射量的波動變化。[39]盧瑟福發現,釷的化合物會持續散發某種放射性氣體,這種氣體會在數小時內保持放射性。他將其稱為「散發物」(Emanation),[40]後來又稱為「釷射氣」(Thorium Emanation,簡稱Th Em)。1901年,他證明此散發物確實具有放射性,但把元素發現者的名譽留給了居禮夫婦。[41]1903年,安德烈-路易·德貝爾恩(André-Louis Debierne)在錒元素中觀測到了類似的散發物,[42][43]即「錒射氣」(Actinium Emanation)。[44]
人們為這三種氣體提出了多套命名方案:1904年的exradio、exthorio和exactinio,[45]1918年的radon、thoron和akton,[46]1919年的radeon、thoreon和actineon[47]以及1920年最終的radon、thoron和actinon。[48]由於這些氣體的光譜與氬、氪和氙相似,而且氣體呈化學惰性,所以威廉·拉姆齊於1904年猜測,散發物可能含有屬於稀有氣體一族的新元素。[45]
1910年,拉姆齊和羅伯特·懷特洛-格雷(Robert Whytlaw-Gray)分離出了氡氣,並對其密度進行了測量,確定它是已知最重的氣體。[49]他們寫道「鐳射氣這一詞十分累贅」,並提出了新的命名「niton」(符號為Nt)。該名稱來自拉丁文「nitens」,意為「發光的」,因為氣體能夠輻射發光。[49]國際原子量委員會於1912年採用了這一命名。1923年,國際化學元素委員會和國際純粹與應用化學聯合會(IUPAC)決定從radon(Rn)、thoron(Tn)和actinon(An)三者中選擇命名。之後,各元素的同位素不再擁有不同的名稱,而是以數字標號,統一命名。因此最穩定同位素radon就成了元素的正式命名,而Tn和An則分別改稱220Rn和219Rn。直到1960年代,文獻一般都只是以「散發物」稱之。[50]1962年合成的氟化氡是首個被合成的氡化合物。[51]
礦場中氡輻射量可以高達1,000,000 Bq/m3。1530年,帕拉塞爾蘇斯曾描述礦工所患的一種疾病,格奧爾格·阿格里科拉因此建議為礦井添加通風系統,以避免這種「山病」(Bergsucht)。[52][53]1879年,這種病症被判定為肺癌。對波希米亞亞希莫夫地區的鈾採礦所作出的調查,是第一項有關氡對健康的影響的研究。[54]在美國,冷戰初期美國西南部鈾礦工人經過數十年的健康問題之後,直到1971年才有安全標準得以實施。[55]
早在1950年,就有關於室內空氣中氡氣含量的記錄。1970年代開始,人們開始研究室內氡氣的來源、影響濃度的因素、對身體的影響以及減輕氡含量的方法。室內氡氣問題於1984年在美國獲得了廣泛的關注和深入的調查。當年,一位工程師在對賓夕法尼亞州一座核電站進行例行監察的時候,被發現受到放射性污染。最終找到的放射性源頭,是其家中濃度過高的氡氣。[56]
存量
濃度單位

222Rn衰變後會產生210Pb。圖為日本的210Pb沉積速率。波動是由氡氣濃度變化所引起的。[57]
氡在環境中的濃度所指的是222Rn同位素的濃度。雖然220Rn和222Rn的平均產生速率相近,但環境中的220Rn卻比222Rn少得多,因為前者的半衰期只有55秒,而後者則有3.8天。[3]
空氣中的氡濃度一般以貝克勒爾每立方米(Bq/m3)的SI導出單位計算。在美國,另一種常見的單位是皮居里每升(pCi/L),轉換關係為:1 pCi/L=37 Bq/m3。[29]日常室內輻射暴露值平均約為48 Bq/m3,但實際波動巨大;室外暴露值為15 Bq/m3。[58]
氡的α潛能:氡的所有子体衰变到210Pb时所发出的α粒子能量总和。单位是J/m3或者MeV/L
礦業一般採用的單位稱為「工作水平」(working level,簡稱WL),累積輻射量則以按月工作水平(working level month,簡稱WLM)計算。1 WL等於1升空氣中任何短壽命222Rn子同位素組合(218Po、214Pb、214Bi及214Po)釋放1.3×105 MeV的α潛能;[29]1 WL也等於2.08×10−5焦耳每立方米空氣(J/m3)。[3]在一個工作月(即170小時)內接受1 WL輻射,就等於1 WLM的累計輻射量。這大約等於在氡濃度為230 Bq/m3的空氣中生活一年。累積輻射量的SI單位為焦耳小時每立方米(J·h/m3),轉換關係為1 WLM=3.6×10−3 J·h/m3。[59]
222Rn會衰變成210Pb以及其他放射性同位素。
自然環境中的氡含量很低,無法以化學方法測得。相對很高的1000 Bq/m3濃度只等同於每立方米含0.17皮克的氡。大氣中氡原子佔所有分子的比例平均為6×10−20,即每毫升150個原子。[60]在整個地球大氣層中的氡輻射量只來源於幾十克的氡,而這些衰變中的氡不斷被鐳和鈾新產生的氡所取代。[61]
自然產生

在離鈾礦不同距離處的氡濃度雙對數圖。粗實線為聯合國原子輻射效應科學委員會(UNSCEAR)的標準模型數值,細實線為薩斯喀徹溫北部礦場的濃度估值。
氡是從鐳-226的放射性衰變所產生的。鐳-226出現在鈾礦、磷鹽岩、頁岩以及花崗岩、片麻岩和片岩等火成岩及變質岩中。石灰石等較常見岩石中則含有較少量的氡。[62]每平方英里、深6英尺(2.6平方公里、深15厘米)的地表土壤內含有約1克的鐳,這些鐳向大氣釋放少量的氡。[3]全球土壤每年估計釋放24億居里(90 TBq)的氡。[63]
不同地方的氡濃度可以有巨大的差異。戶外空氣中濃度介乎1至100 Bq/m3,在海面則更低(0.1 Bq/m3)。在洞穴、通風的礦井以及不通風的房屋內,濃度可高達20至2,000 Bq/m3。[64]美國鈾礦作業守則規定氡濃度須在一個「工作水平」以下。中国铀矿冶EJ/T378-89规定工作场所氡浓度≤3700Bq/m3,即相当于美国的1WL。1976年至1985年所測量數據顯示,第95百分位水平可以高達近3個工作水平(每升空氣含546 pCi氡-222,即20.2 kBq/m3)。[3]奧地利巴特加斯泰因未通風的礦井中氡濃度平均值為43 kBq/m3(1.2 nCi/L),最高值為160 kBq/m3(4.3 nCi/L)。[65]
氡主要通過鐳和鈾衰變系產生(222Rn),微量經釷衰變系產生(220Rn)。土地和建築材料只要含有微量的鈾或釷,就會自然散發出氡氣,特別是在鈾濃度較高的花崗岩和頁岩地區。然而,並不是所有的花崗岩地區都會發出高濃度的氡氣。氡是一種稀有氣體,可以經土地的空隙和裂縫中轉移至地表,並會積聚在洞穴和水源中。由於半衰期非常短(222Rn只有4天),所以隨著離源頭距離的增大,氡的濃度會迅速下降。季節和氣候對氡的濃度有很大的影響,例如在逆溫和無風狀態下空氣會有較高濃度的氡。[66]
某一些泉水和溫泉可釋放高濃度的氡。[67]美國蒙大拿州博爾德鎮、日本鳥取縣三朝町、德國巴特克罗伊茨纳赫等地都擁有釋放氡氣的高鐳含量泉水。泉水的氡濃度要超過2 nCi/L(74 kBq/m3)才會被歸類為氡礦物水源。[68]意大利梅拉諾的泉水含2,000 kBq/m3的氡,而路利西亞(Lurisia)的泉水氡濃度甚至高達4,000 kBq/m3。[65]
地球大氣層中的氡濃度非常低,所以表面水中的氡會迅速揮發到空氣當中。岩石中的226Ra會不斷衰變產生222Rn,因此地下水具有較高的氡濃度。同樣,在土地下的飽和帶的氡含量比不飽和帶高。[69][70]
一些石油也含有氡。由於氡的壓力溫度曲線和丙烷相似,所以煉油廠在根據不同沸點分離石油成份後,輸出的丙烷部份可能會具有放射性。[71]
不少石油及天然氣工業所產生的殘留物都含有鐳及其衰變產物。油井中的硫酸鹽垢有時會含有鐳,而水、石油和天然氣則有時含有氡。氡的衰變產物會在管道內壁形成一層固體放射性物質。[71]
1971年,阿波羅15號在經過月球阿里斯塔克斯隕石坑上空110公里處時,探測到α粒子數急劇上升。當時科學家推斷α粒子來自222Rn。之後從月球勘探者α粒子光譜儀所取得的數據可以推論,α粒子數的上升的確是222Rn所引起的。[72]
室內累積

美國北達科他州住宅典型的氡氣對數正態分佈
住房內可含有高濃度氡氣是在1985年意外發現的。美國工程師斯丹利·瓦特拉斯(Stanley Watras)在進入一座核電站前接受嚴格的輻射測試時,被發現曾受放射性物質污染。其後人們發現,污染的源頭是其家中濃度過高的氡氣。[73]一般的家居氡輻射量約為100 Bq/m3(1.3 pCi/L),大部份建築內都有少量的氡。大部份的氡是經過房屋最底層與地表接觸的地方進入室內的,這些進入點包括地基裂縫、建築接口、牆壁空隙和孔洞、管道周圍的空間以及供水管等。[2]在一個小時內,氡在同一個地點的濃度波動幅度可達到兩倍。濃度在同一座房屋的不同房間也會有巨大的差異。[3]
在同一地帶內的室內氡濃度的一般假設符合對數正態分佈。[74]所以在估算氡濃度「平均值」時,通常使用幾何平均值。[75]
在一些歐洲國家,平均濃度範圍可低至10 Bq/m3以下,高至100 Bq/m3以上。[76]典型的幾何標準差介乎2至3之間,也就是(根據68-95-99.7規則)氡濃度有2%到3%的機會比幾何平均值高出100倍。
愛爾蘭科克郡馬樓鎮(Mallow)曾錄得最高濃度值之一,引發當地居民有關肺癌的憂慮。美國氡濃度最高的地區位於愛荷華州和賓夕法尼亞州東南部的阿巴拉契亞山脈。[77]愛荷華州之所以有偏高的平均氡濃度,是因為大型冰川作用將加拿大地盾的花崗岩磨碎後,岩石沉積並組成了愛荷華地區的泥土。[78]州內的許多城市,如愛荷華城,都有規定新造房屋必須有預防氡氣的設施。一些地區利用鈾礦渣作堆填,因此後來建造於其上的房屋可能會有較高的氡輻射量。[3]
「密閉」、「通風不足」、「一樓的地板有裂縫,使得土壤中的氡逸散到室內」的建築,將有較高濃度的氡。
工業生產
氡是鈾礦加工過程中用1%氫氯酸或氫溴酸浸洗之後的副產品之一。溶液中提取出的氣體混合物包含H2、O2、He、Rn、CO2、H2O和各種烴。在720 °C下使氣體接觸銅,可移除H2和O2;KOH和P2O5則可以以吸附作用移除酸和水氣。最後可用液氮冷凝氡氣,再用昇華過程把氡氣從其他殘餘物中分離出來。[79]
氡的商業買賣是受到管制的,但在校準222Rn測量儀器的情況下可以購買少量含有氡的鐳溶液。每毫升鐳溶液價格近6千美元,而且每一時刻只含有約15皮克的氡。[80]溶液所含的鐳-226經α衰變,半衰期為1600年。氡是其中一種衰變產物,其累積速率約為1 mm3每天每1克鐳。衰變迅速達致平衡,溶液會不斷產生新的氡,其放射性將與鐳相同(50 Bq)。氣態222Rn(半衰期約為4天)會擴散並逃逸出容器。[81]
濃度表
| Bq/m3 | pCi/L | 出現環境 |
|---|---|---|
1 | ~0.027 | 海洋表面或南極洲空氣的氡濃度可以低於0.1 Bq/m3。[82] |
10 | 0.27 | 室外地表空氣平均濃度為4至15 Bq/m3。[83] |
100 | 2.7 | 室內輻射量。不少國家都以200至400 Bq/m3作為室內空氣輻射量的參照指標。如果測試得出少於150 Bq/m3的濃度,則情況安全。在一年時間以內累積230 Bq/m3的氡輻射量相等於1 WLM(按月工作水平)。鈾礦的合格濃度為1,220 Bq/m3(33 pCi/L)以下。[84] |
1,000 | 27 | 一些在高鈾含量或滲透性強的土壤上建造的房屋曾錄得很高的氡濃度(高於1000 Bq/m3)。如果濃度高於800 Bq/m3,就有必要對房屋進行降低氡濃度的措施。[83] |
10,000 | 270 | 巴特加斯泰因未通風礦井的空氣平均氡濃度為43 kBq/m3,曾錄得最高值為160 kBq/m3。[65] |
100,000 | ~2700 | 斯丹利·瓦特拉斯(Stanley Watras)的地下室氡濃度約為100,000 Bq/m3。[85][86] |
1,000,000 | 27000 | 不通風的鈾礦可以有高達1,000,000 Bq/m3的氡濃度。 |
5.54 × 1019 | ~1.5 × 1018 | 理論上限:100%濃度的氡氣(222Rn,1大氣壓力,0 °C),相等於1.538×105 Ci/g、[87]5.54×1019 Bq/m3。 |
累积剂量
UNSCEAR 1993年报告中采用的氡-222的剂量转换因子为9nSv/(Bq/m3);平衡因子(氡与其短寿命子体平衡态的度量)室内取0.4,室外取0.6;居留因子室内取0.8,室外取0.2。导出氡-222的年有效剂量:
室内:40Bq/m3 × 0.4 × 7000h × 9nSv/(Bq/m3) = 1.0mSv
室外:10Bq/m3 × 0.6 × 1760h × 9nSv/(Bq/m3) = 0.095mSv
應用
醫學
20世紀初,庸醫曾利用氡來治療各種疾病。[88]病人在密封的小房間內接觸氡,以獲取「治療功效」。很快人們便發現,氡的致電離輻射能夠致癌。雖然氡的放射性可以殺死癌細胞,[89]但它對健康細胞同樣有損害。致電離輻射會導致自由基的形成,進而在細胞及基因上造成更大的傷害,甚至會引發癌症。
曾有人提出用氡的輻射激效來治療關節炎等自體免疫性疾病。[90][91]20世紀末至21世紀初,美國蒙大拿州傑佛遜縣的一些「健康礦井」吸引了不少渴望消除關節炎等疾病的人來飲用放射性井水和暴露在氡氣之中。然而因為高劑量輻射會對身體產生負面影響,所以這一療法並不受到醫生的鼓勵。[92]
捷克亚希莫夫自1906年起便有使用放射性水浴,而奧地利巴特加斯泰因則在氡被發現之前就已有放射性水浴的使用。日本鳥取縣三朝町也有富含鐳的溫泉。德國巴德布兰巴赫則有飲用放射性水的療法。奧地利加斯泰納-海爾施多蘭(Gasteiner-Heilstollen)、波蘭希維拉杜夫-茲德魯伊、切爾涅瓦-茲德魯伊(Czerniawa-Zdrój)、科瓦雷、隆代克-茲德魯伊等地、羅馬尼亞米耶爾庫雷亞丘克和美國蒙大拿州傑佛遜縣都有吸入含氡空氣的療法。在美國和歐洲有各種氡水療,人們相信在這種高氡含量環境下暴露幾分鐘至幾個小時,所受到的輻射有提神的作用。[91][93]
氡可用於放射治療,但大部份已被粒子加速器及核反應爐所產生的其他放射性同位素所取代。氡可以經金或玻璃「種子」植入體內,用於治療癌症。鐳所放出的氡氣經一個泵進入一條金製長管進行收集,長管再經擠壓、切割,形成多個較短的部份。金可以包住氡氣,並阻止α和β粒子的逃離,只濾出氡及其衰變鏈中的短壽命同位素(218Po、214Pb、214Bi、214Po)所發出的伽馬射線,從而殺死病變細胞。每個種子的輻射量在0.05至5毫居里(2至200 MBq)之間。[89]
氡以及衰變鏈中的首幾個衰變產物都具有較短的壽命,因此種子一開始留在體內。在12個半衰期(43天)之後,氡的輻射量已達到原先的2000分之一。此時主要的殘餘輻射來自氡的衰變產物之一210Pb,以及它的子同位素210Bi和210Po。210Pb的半衰期為22.3年,即氡的2000倍,輻射量因此是氡的2000分之一。
20世紀初,一些受210Pb污染的金進入了美國珠寶業。這是因為曾經含有222Rn的金種子在氡衰變殆盡後,經過重新熔化流入了市場。[94][95]
科學研究
泥土發出氡氣的量隨土壤類型和表面鈾含量而改變。一些大氣學專家利用這一現象來追蹤空氣的流動。由於氡會迅速流失到大氣之中並且衰變,所以可在水文學中用於研究地下水和溪水之間的相互作用。溪中若含有較高濃度的氡,就意味著附近有地下水的注入。
地質斷層上方的氡濃度較高,所以通過測量氡在土壤中的濃度,可以測繪地表斷層地圖。[96]同樣,氡濃度可以用來測量地溫梯度。[97]
一些科學家研究地下水氡濃度的變化是否可以作地震預測。[98][99][100]氡的半衰期有3.8天,所以可在地底裂縫剛形成後不久被探測到。有科學家猜想,氡濃度的上升是新的地底裂縫形成的跡象。裂縫促進了地下水的流動,使氡得以逃逸出來。新裂縫有可能是大型地震的前兆。然而在1970至1980年代,人們通過測量發現,斷層附近的氡濃度並未因地震而升高,有時測量到氡以後也沒有發生地震。因此以氡作為地震發生的指標並不可靠。[101]截至2009年,美國太空總署正在調查氡氣濃度變化有否可能是地震發生的前兆之一。[102]
氡是地熱發電廠的污染物之一,因為從地底深處所抽出的物質含有氡。但是氡能快速散發,所以不少調查都發現其放射性不會造成危害。另外,地熱發電過程一般會將抽出的物質再次打入地底,所以對環境的影響較小。[103]
氡曾在1940至50年代用於工業放射性攝像。[104][105]第二次世界大戰後不久,其他價格更低、α輻射危害較低的X射線源便取代了氡。
健康危害
礦井
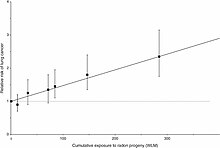
縱軸為肺癌致死的相對風險,橫軸為氡衰變產物的累積輻射量(按月工作水平,WLM)。數據是對11隊地底採石礦工調查後綜合而得。雖然高輻射量(>50 WLM)統計上會導致更多的癌症,但少量輻射(10 WLM)卻沒有明確結論,甚至在此研究中顯得有微小的益處。
氡-222的衰變產物已被國際癌症研究機構列為人類致癌物質。[106]由於氡氣可以吸入體內,所以長期暴露在氡氣之中的人患上肺癌的機率較高。1940至50年代,安裝礦井通風系統的安全標準尚未實施,[107]因此在捷克共和國、美國西南部和南澳的非吸煙鈾礦工人和採石工人當中,氡氣與肺癌有直接聯繫。[108][109][110][111]儘管人們早在1950年代就已了解氡氣的危險,[112]但在1970年代之前,有關氡氣的安全措施都沒有得到妥善的管理。這段時間在美國甚至有商人向公眾開放廢棄鈾礦,並宣傳呼吸地底氡氣的健康功效,包括舒緩哮喘、痛風以及各種疼痛不適。[113][114]然而研究已證明氡氣是沒有這些功效的。[115]
在實施通風系統等措施之後,大部份礦井的氡水平已經降低,一些鈾礦工人的年均輻射值已經降至一般家中的水平。這有效減少了職業所致的癌症,但目前仍在高氡濃度礦井工作或曾在這些礦井工作的工人仍可能有相關的健康問題。[116]礦工患癌的相對危險度降低之後,對額外風險的探測也變得更加困難。[117]
除了肺癌以外,科學家也猜測氡會引發白血病。對於公眾所進行的各項調查並未得出一致的結論,但針對鈾礦工人的一項研究則發現氡的輻射量與慢性淋巴細胞性白血病有直接的關係。[118]
家居暴露水平
美國、歐洲和中國的多項病例對照研究都指出,氡(準確來說是氡的衰變產物)與肺癌有關聯。美國每年約有2萬1千人因氡所引致的肺癌而死亡。[6]其中一項大型試驗發現,就算是美國環保局所建議的4 pCi/L水平,長期暴露也會使患肺癌的風險增加50%。[119]

一項有爭議的流行病學研究顯示,家居氡輻射量與患癌風險呈負相關性。(5 pCi/L ≈ 200 Bq/m3)[120]此項研究缺乏在吸煙和氡暴露上的對照,所以沒有足夠的統計效力作出明確的結論。因此圖中的誤差棒很可能過小。[121]國際衛生組織的國際癌症研究機構認為這些結果並不成立。[122]
大部份有關家居氡輻射量的模型都以礦工為基礎。[116]由於吸煙等其他健康因素甚多,所以有關家居氡輻射量對健康影響的直接估計和測量是極為困難的。
美國環保局將氡列為第二位肺癌成因及第一位環境致癌因素。[123]英國[116]和法國也得出了類似的研究結果。[124]室內氡暴露主要來自地底岩石和建築材料(例如花崗岩),而建築物地基裂縫漏氣或通風不良也可增加室內氡氣濃度。
行動水平及參考水平
世界衛生組織於2009年提出了100 Bq/m3的建議住宅參考水平。如果這項水平無法達到,則應以300 Bq/m3作為最高水平。此參考水平不作為限制,而應是全年平均氡濃度的可接受最高值。[125]
不同組織會建議不同的行動水平。例如,美國環保局建議在74 Bq/m3(2 pCi/L)的水平就要做出行動,[58]而歐盟則建議舊房屋內達到400 Bq/m3(11 pCi/L)或新房屋內達到200 Bq/m3(5 pCi/L)時須做出行動。[126]英國健康保護局於2010年7月8日所發佈的新建議把100 Bq/m3列為「目標水平」,並將行動水平保持在200 Bq/m3。[127]2010起,挪威使用與英國相同的水平,所有新房屋都必須有防護氡氣的設施。
與吸煙的關係
研究已證實,家居氡氣會導致患肺癌的風險增加。不過,吸煙是一項極大的誤差來源,所以有關肺癌成因的研究結論須非常謹慎地對待。
根據美國環保局,吸煙者的患癌風險會因吸煙和氡氣的協和作用而大大提高。這一人群中每千人會有62人死於肺癌,從未吸煙者中每千人只有7人會死於肺癌。[6]然而除了氡氣以外,非吸煙者患癌風險也可能來自二手煙(見下文)。
和其他已知或懷疑肺癌成因一樣,氡對於吸煙者和非吸煙者都是一項健康威脅。歐洲的一項匯集研究已證明了這一點。[128]研究指出,對象的肺組織病型會影響氡氣對他的影響程度:氡的危險性對小細胞肺癌患者(幾乎全是吸煙者)較高,對如肺腺癌等主要影響非吸煙者的病型則較低。[128][129]針對這項研究的一篇評論認為,「單單提及家居氡氣的治病風險是不恰當的。風險既來自吸煙,又來自氡對吸煙者的協和作用。如果沒有吸煙,則影響似乎是微不足道的。」[130]
一項有關乳房切除術後放射治療輻射的研究顯示,[131]有必要發展簡單的模型,以評估吸煙和輻射對患癌風險的結合及獨立效應。對線性無閾值模型(LNT)計算方法的新的討論也支持這一觀點。[132]
與二手煙的關係
在二手煙和家居氡氣之間的協和作用上,研究並不充分。從歐洲的匯集研究數據無法判斷,這種協和作用是否造成了非吸煙者稍稍提高的患癌風險。
2001年的一項實驗[133]調查了436位患了肺癌的從未吸煙者及1649位從未吸煙者對照組,並顯示氡氣使從未吸煙者的患肺癌風險增高。遭受二手煙的人承受了全部的風險升幅,而不在二手煙環境下的人則沒有因氡氣水平的升高而提高患癌風險。
食水
科學家對進食氡對人體的影響所知甚少。研究指出,氡的生物半衰期在30到70分鐘之間,在100分鐘後有90%的移除率。1999年,美國國家研究委員會對食水所含的氡氣進行調查,並發現攝入後的健康風險幾乎可以忽略。[134]來自地底的水源可以因周邊的岩石和泥土而含有大量的氡氣,而地表水源的氡含量則一般較低。[135]
除經食水進入體內以外,氡氣還可以在水溫升高、水壓降低以及與空氣接觸時釋放出來。淋浴為氡氣的釋放製造了最佳的條件。在一般用水情況下,含有104 pCi/L氡氣的水可以使室內空氣的氡濃度提高1 pCi/L。[136]
測試及預防

氡氣試驗盒
簡單的氡氣測試共有幾種。在某些國家,這些測試通常在已知氡氣風險較高的地方定期進行。作篩查之用的短期氡氣測試器價格便宜,有時甚至是免費的。短期氡氣測試有非常重要、必須遵守的步驟。試驗盒中的採集器須先在房屋最底層放置2至7天,再送往實驗室分析。另外也有可長期測量氡氣的測試器,採集時間可長至一年。利用室外試驗盒可以在建築施工開始之前測試氡氣水平。[6]
氡氣水平會因天氣等因素自然波動,所以首次測試可能不能準確反應家居平均氡氣水平。在一天當中溫度最低、壓差最大之時,氡氣水平最高。[62]因此,如果最初數值較高(超過4 pCi/L),就應再次進行測試,以避免因倉促展開降低氡氣的措施而浪費金錢。如得出4至10 pCi/L之間的數值,則有必要進行長期氡氣測量。如數值超过10 pCi/L,則只要再進行一次短期測試,以免延誤實施所需的安全措施。[6]
由於氡的半衰期只有3.8天,所以在源頭被移除後數星期內,氡氣水平就會大大降低。改善房屋的通氣設施亦可減少氡氣。在一般情況下,通氣越差,室內氡氣濃度就越高。[3]如果房屋通風良好,室內外氡氣水平應該一致,在1至100 Bq/m3間,通常為10 Bq/m3)。[6]
減少氡氣在房屋內積累的主要方法共有四種:[6][137]
- 分板減壓(土壤抽吸),加強底層通風;
- 加強整個房屋的通風,並避免氡氣從地下室流入起居室;
- 在地下室安裝氡氣儲槽;
- 安裝正壓通風系統。
美國環保局建議以通風管道及抽風機將土壤中的氡氣轉移至室外遠離窗戶及其他建築物進出口處。此做法稱為分板減壓,亦稱土壤抽吸,能避免氡氣進入建築物。[6]但環保局不建議只密封地縫、孔洞,因為這種方法無法可靠地大量降低氡氣水平。[138]
正壓通風系統可以和熱交換器一同使用,以減少在與室外交換空氣的時候所喪失的能量。直接把地下室空氣吹出室外並不可行,因為氡氣可能會因此被抽入室內。如果房屋底下是一層窄小的管道空間,則可以用一層塑料膜隔開空間內的氡氣,[6][139]並用抽風系統將氡氣引導至室外。[138]
參考資料
^ Haynes, William M. (编). CRC Handbook of Chemistry and Physics 92nd. Boca Raton, FL: CRC Press. 2011: 4.122. ISBN 1439855110.
^ 2.02.1 A Citizen's Guide to Radon | Radon | US EPA. Epa.gov. 2010-08-05 [2012-04-28].
^ 3.03.13.23.33.43.53.63.7 Toxicological profile for radon, Agency for Toxic Substances and Disease Registry, U.S. Public Health Service, In collaboration with U.S. Environmental Protection Agency, December 1990.
^ Public Health Fact Sheet on Radon — Health and Human Services. Mass.Gov. [2011-12-04]. (原始内容存档于2011-11-21).
^ Facts about Radon. Facts about. [2008-09-07]. (原始内容存档于2005-02-22).
^ 6.06.16.26.36.46.56.66.76.8 A Citizen's Guide to Radon. www.epa.gov. United States Environmental Protection Agency. October 12, 2010 [January 29, 2012].
^ Radon. All Measures. 2004 [2008-02-12]. (原始内容存档于2011-08-09).
^ Williams, David R. Earth Fact Sheet. NASA. 2007-04-19 [2008-06-26].
^ Radon. Jefferson Lab. [2008-06-26].
^ Thomas, Jens. Noble Gases. Marshall Cavendish. 2002: 13. ISBN 978-0-7614-1462-9.
^ Kal’muk Bryk, S.D.; Makitra, R.G.; Pal’chikova, E.Y. Solubility and distribution of radon in organic solvents. Russ J Gen Chem. 2007, 77: 503. doi:10.1134/S1070363207040020.
^ Bader, Richard F. W. An Introduction to the Electronic Structure of Atoms and Molecules. McMaster University. [2008-06-26].
^ David R. Lide. Section 10, Atomic, Molecular, and Optical Physics; Ionization Potentials of Atoms and Atomic Ions. CRC Handbook of Chemistry and Physics, 84th Edition. Boca Raton, Florida: CRC Press. 2003.
^ Avrorin, V V; Krasikova, R N; Nefedov, V D; Toropova, M A. The Chemistry of Radon. Russian Chemical Reviews. 1982, 51: 12. Bibcode:1982RuCRv..51...12A. doi:10.1070/RC1982v051n01ABEH002787.
^ Stein, L. Ionic Radon Solution. Science. 1970, 168 (3929): 362–4. Bibcode:1970Sci...168..362S. PMID 17809133. doi:10.1126/science.168.3929.362.
^ Pitzer, Kenneth S. Fluorides of radon and element 118. J. Chem. Soc., Chem. Commun. 1975, (18): 760–1. doi:10.1039/C3975000760b.
^ Meng- Sheng Liao; Qian- Er Zhang. Chemical Bonding in XeF2, XeF4, KrF2, KrF4, RnF2, XeCl2, and XeBr2: From the Gas Phase to the Solid State. The Journal of Physical Chemistry A. 1998, 102 (52): 10647. doi:10.1021/jp9825516.
^ Filatov, Michael; Cremer, Dieter. Bonding in radon hexafluoride: An unusual relativistic problem?. Physical Chemistry Chemical Physics. 2003, 5 (6): 1103. Bibcode:2003PCCP....5.1103F. doi:10.1039/b212460m.
^ 19.019.119.2 Sykes, A. G. Recent Advances in Noble-Gas Chemistry. Advances in Inorganic Chemistry 46. Academic Press. 1998: 91–93 [2012-11-02]. ISBN 978-0120236466.
^ 20.020.1 Thayer, John S. Relativistic Effects and the Chemistry of the Heavier Main Group Elements: 80. 2010. doi:10.1007/978-1-4020-9975-5_2.
^ Holloway, J. Noble-gas fluorides. Journal of Fluorine Chemistry. 1986, 33: 149. doi:10.1016/S0022-1139(00)85275-6.
^ Avrorin, V. V.; Krasikova, R. N.; Nefedov, V. D.; Toropova, M. A. The Chemistry of Radon. Russ. Chem. Review. 1982, 51: 12. Bibcode:1982RuCRv..51...12A. doi:10.1070/RC1982v051n01ABEH002787.
^ Malli, Gulzari L. Prediction of the existence of radon carbonyl: RnCO. International Journal of Quantum Chemistry. 2002, 90 (2): 611. doi:10.1002/qua.963.
^ Runeberg, Nino; Pyykk, Pekka. Relativistic pseudopotential calculations on Xe2, RnXe, and Rn2: The van der Waals properties of radon. International Journal of Quantum Chemistry. 1998, 66 (2): 131. doi:10.1002/(SICI)1097-461X(1998)66:2<131::AID-QUA4>3.0.CO;2-W.
^ Browne, Malcolm W. Chemists Find Way to Make An 'Impossible' Compound. The New York Times. 1993-03-05 [2009-01-30].
^ 26.026.126.2 Sonzogni, Alejandro. Interactive Chart of Nuclides. National Nuclear Data Center: Brookhaven National Laboratory. [2008-06-06].
^ Principal Decay Scheme of the Uranium Series. Gulflink.osd.mil. [2008-09-12]. (原始内容存档于2008年10月25日).
^ Why Measure RDPs?. [2009-07-07]. (原始内容存档于2008-11-21).
^ 29.029.129.2 EPA Assessment of Risks from Radon in Homes (PDF). Office of Radiation and Indoor Air, US Environmental Protection Agency. June 2003. (原始内容 (PDF)存档于2008-02-27).
^ Health effects of exposure to radon, Volume 6 of BEIR (Series). National Academies Press. 1999: 179. ISBN 0-309-05645-4.
^ Dorn, F. E. Die von radioactiven Substanzen ausgesandte Emanation (PDF). Abhandlungen der Naturforschenden Gesellschaft zu Halle. 1900, 23: 1–15.
^ Partington, J. R. Discovery of Radon. Nature. 1957, 179 (4566): 912. Bibcode:1957Natur.179..912P. doi:10.1038/179912a0.
^ Timeline of Element Discovery. The New York Times Company. 2008 [2008-02-28].
^ Partington, J. R. Discovery of Radon. Nature. 1957, 179 (4566): 912. Bibcode:1957Natur.179..912P. doi:10.1038/179912a0.
^ Schüttmann, W. Zur Entdeckungsgeschichte des Radons. Isotopenpraxis Isotopes in Environmental and Health Studies. 1988, 24 (4): 158. doi:10.1080/10256018808623931.
^ Brenner, David J. Rutherford, the Curies, and Radon. Medical Physics. 2000, 27 (3): 618. Bibcode:2000MedPh..27..618B. PMID 10757614. doi:10.1118/1.598902.
^ Dorn, Friedrich Ernst. Ueber die von radioaktiven Substanzen ausgesandte Emanation. Abhandlungen der Naturforschenden Gesellschaft zu Halle (Stuttgart). 1900, 22: 155.
^ Curie, P.; Curie, Mme. Marie. Sur la radioactivite provoquee par les rayons de Becquerel. Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1899, 129: 714–6.
^ Rutherford, E.; Owens, R. B. Thorium and uranium radiation. Trans. R. Soc. Can. 1899, 2: 9–12.The radiation from thorium oxide was not constant, but varied in a most capricious manner," whereas "All the compounds of Uranium give out a radiation which is remarkably constant.
^ Rutherford, E. A radioactive substance emitted from thorium compounds. Phil. Mag. 1900, 40: 1–4.
^ Rutherford, E.; Brooks, H.T. The new gas from radium. Trans. R. Soc. Can. 1901, 7: 21–5.
^ Giesel, Fritz. Ueber den Emanationskörper aus Pechblende und über Radium. Chemische Berichte. 1903, 36: 342. doi:10.1002/cber.19030360177.
^ Debierne, André-Louis. Sur la radioactivite induite provoquee par les sels d'actinium. Comptes rendus hebdomadaires des seances de l'Academie des sciences. 1903, 136: 446.
^ McKeehan, L. W. The Diffusion of Actinium Emanation and the Range of Recoil from it. Phys. Rev. 1917, 10: 473. doi:10.1103/PhysRev.10.473.
^ 45.045.1 Ramsay, Sir William; Collie, J. Normal. The Spectrum of the Radium Emanation. Proceedings of the Royal Society. 1904, 73 (488–496): 470–6. doi:10.1098/rspl.1904.0064.
^ Schmidt, Curt. Periodisches System und Genesis der Elemente. Z. Anorg. Ch. 1918, 103: 79–118. doi:10.1002/zaac.19181030106.
^ Perrin, J. Radon. Ann. Physique. 1919, 11: 5.
^ Adams, Elliot Quincy. The Independent Origin of Actinium. J. Amer. Chem. Soc. 1920, 42 (11): 2205. doi:10.1021/ja01456a010.
^ 49.049.1 Ramsay, W.; Gray, R. W. La densité de l'emanation du radium. Comptes rendus hebdomadaires des seances de l'Academie des sciences. 1910, 151: 126–8.
^ Grosse, A. V. Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em). Journal of Inorganic and Nuclear Chemistry (Elsevier Science Ltd.). 1965, 27 (3): 509. doi:10.1016/0022-1902(65)80255-X.
^ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. Radon Fluoride. J. Amer. Chem. Soc. 1962, 84 (21): 4164. doi:10.1021/ja00880a048.
^ Le radon, aspects historiques et perception du risque, Roland Masse.
^ Radon Toxicity: Who is at Risk?, Agency for Toxic Substances and Disease Registry, 2000.
^ Proctor, Robert N. The Nazi War on Cancer. Princeton University Press, 2000 p. 99 ISBN 978-0-691-07051-3.
^ Edelstein, Michael R., William J. Makofske. Radon's deadly daughters: science, environmental policy, and the politics of risk. Rowman & Littlefield, 1998, pp. 36–39 ISBN 978-0-8476-8334-5.
^ Samet, J. M. Indoor radon and lung cancer. Estimating the risks. The Western journal of medicine. 1992, 156 (1): 25–9. PMC 1003141. PMID 1734594.
^ Yamamoto, M.; Sakaguchi, A; Sasaki, K; Hirose, K; Igarashi, Y; Kim, C. Radon. Journal of Environmental Radioactivity. 2006, 86 (1): 110–31. PMID 16181712. doi:10.1016/j.jenvrad.2005.08.001.
^ 58.058.1 Radiation Protection: Radon. United States Environmental Protection Agency. November 2007 [2008-04-17].
^ Radon (Rn). CEA. 12 April 2005.(法文)
^ Health hazard data (PDF). The Linde Group. [2008-06-26].
^ Le Radon. Un gaz radioactif naturel. [2009-07-07].
^ 62.062.1 Thad. Godish, (2001) . "Indoor Environment Quality". Boca Raton, FL. CRC Press LLC.
^ J. H. Harley. Noble gases. U.S. Environmental Protection Agency. 1975: 109–114.
^ Sperrin, Malcolm; Gillmore, Gavin; Denman, Tony. Radon concentration variations in a Mendip cave cluster. Environmental Management and Health. 2001, 12 (5): 476. doi:10.1108/09566160110404881.
^ 65.065.165.2 Zdrojewicz, Zygmunt; Strzelczyk, Jadwiga (Jodi). Radon Treatment Controversy, Dose Response. Dose-Response. 2006, 4 (2): 106–18. PMC 2477672. PMID 18648641. doi:10.2203/dose-response.05-025.Zdrojewicz.
^ Steck, Daniel J.; Field, R. William; Lynch, Charles F. Exposure to Atmospheric Radon. Environmental Health Perspectives. 1999, 107 (2): 123–127. JSTOR 3434368. PMC 1566320. PMID 9924007. doi:10.2307/3434368.
^ Field, R. William. Radon Occurrence and Health Risk (PDF). Department of Occupational and Environmental Health, University of Iowa. [2008-02-02]. (原始内容 (PDF)存档于2009-11-22).
^ The Clinical Principles Of Balneology & Physical Medicine. [2009-07-07]. (原始内容存档于2008年5月8日).
^ The Geology of Radon. United States Geological Survey. [2008-06-28].
^ Radon-222 as a tracer in groundwater-surface water interactions (PDF). Lancaster University. [2008-06-28].
^ 71.071.1 Potential for Elevated Radiation Levels In Propane (PDF). National Energy Board. April 1994 [2009-07-07].
^ Lawson, S.; Feldman, W.; Lawrence, D.; Moore, K.; Elphic, R.; Belian, R. Recent outgassing from the lunar surface: the Lunar Prospector alpha particle spectrometer. J. Geophys. Res. 2005, 110: 1029. Bibcode:2005JGRE..11009009L. doi:10.1029/2005JE002433.
^ Roaf, Susan; Fuentes, Manuel & Thomas, Stephanie. Ecohouse: A Design Guide. Elsevier. 2007: 159. ISBN 0-7506-6903-9.
^ 多項參考,詳細論述請見:Analysis And Modelling Of Indoor Radon Distributions Using Extreme Values Theory或Indoor Radon in Hungary (Lognormal Mysticism)。
^ Data Collection and Statistical Computations. [2009-07-07].
^ Annex E: Sources to effects assessment for radon in homes and workplaces (PDF), Report of the United Nations Scientific Committee on the Effects of Atomic Radiation (2006) (United Nations), 2008, 2: 209–10 [17 August 2013]
^ Price, Phillip N.; Nero, A.; Revzan, K.; Apte, M.; Gelman, A.; Boscardin, W. John. Predicted County Median Concentration. Lawrence Berkeley National Laboratory. [2008-02-12]. (原始内容存档于2007-12-31).
^ Field, R. William. The Iowa Radon Lung Cancer Study. Department of Occupational and Environmental Health, University of Iowa. [2008-02-22]. (原始内容存档于1997-07-11).
^ Radon Production. Rn-radon.info. 2007-07-24 [2009-01-30]. (原始内容存档于2008-10-28).
^ SRM 4972 – Radon-222 Emanation Standard. National Institute of Standards and Technology. [2008-06-26].
^ Collé, R. & R. Kishore. An update on the NIST radon-in-water standard generator: its performance efficacy and long-term stability. Nucl. Instrum. Meth. A. 1997, 391 (3): 511–528. Bibcode:1997NIMPA.391..511C. doi:10.1016/S0168-9002(97)00572-X.
^ Pereira, Enio B. Radon-222 time series measurements in the Antarctic peninsula (1986-1987). Tellus. 1990, 42B: 39–45.
^ 83.083.1 M. Maroni; B. Seifert; T. Lindvall. Indoor Air Quality: A Comprehensive Reference Book. 1995.
^ The Mining Safety and Health Act - 30 CFR 57.0. United States Government. 1977 [2014-07-30].
^ Thomas, John J.; Thomas, Barbara R.; Overeynder, Helen M. Indoor Radon Concentration Data: Its Geographic and Geologic Distribution, an Example from the Capital District, NY (PDF). International Radon Symposium. Nashville, TN: American Association of Radon Scientists and Technologists. September 27–30, 1995 [2012-11-28].
^ Upfal, Mark J.; Johnson, Christine. 65 Residential Radon. (编) Greenberg, Michael I.; Hamilton, Richard J.; Phillips, Scott D.; N.N., Gayla J. Occupational, industrial, and environmental toxicology (PDF) 2nd. St Louis, Missouri: Mosby. 2003 [28 November 2012]. ISBN 9780323013406. [永久失效連結]
^ Toxicological Profile for Radon, Table 4-2 (Keith S, Doyle JR, Harper C, et al. Toxicological Profile for Radon. Atlanta (GA): Agency for Toxic Substances and Disease Registry (US); 2012 May. 4, CHEMICAL, PHYSICAL, AND RADIOLOGICAL INFORMATION.) Retrieved 2015-06-06
^ The Clinique, Volume 34. Illinois Homeopathic Medical Association. 1913 [2011-06-30].
^ 89.089.1 Radon seeds. [2009-05-05].
^ Radon Health Mines: Boulder and Basin, Montana. Roadside America. [2007-12-04].
^ 91.091.1 Neda, T; 等. Radon concentration levels in dry CO2 emanations from Harghita Băi, Romania, used for curative purposes. Journal of Radioanalytical and Nuclear Chemistry. 2008, 277 (3): 685. doi:10.1007/s10967-007-7169-0.
^ Salak, Kara; Nordeman, Landon. 59631: Mining for Miracles. National Geographic (National Geographic Society). 2004 [2008-06-26].
^ Jáchymov. Petros. [2008-06-26]. (原始内容存档于2002年1月7日).
^ Poster Issued by the New York Department of Health (ca. 1981). Oak Ridge Associated Universities. 2007-07-25 [2008-06-26].
^ Rings and Cancer. Time. 1968-09-13 [2009-05-05].
^ Richon, P.; Y. Klinger; P. Tapponnier; C.-X. Li; J. Van Der Woerd & F. Perrier. Measuring radon flux across active faults: Relevance of excavating and possibility of satellite discharges (PDF). Radiat. Meas. 2010, 45 (2): 211–218. doi:10.1016/j.radmeas.2010.01.019.
^ Radon Transect Analysis In Geothermal Reservoirs
^ Igarashi, G.; Wakita, H. Geochemical and hydrological observations for earthquake prediction in Japan. Journal of the Physics of the Earth. 1995, 43 (5): 585–598. doi:10.4294/jpe1952.43.585.
^ Wakita, H., (1996). Earthquake chemistry II, collected papers, edn, Vol. II, Laboratory for Earthquake Chemistry, Faculty of Science, University of Tokyo, Japan
^ Richon, P.; Sabroux, J.-C.; Halbwachs, M.; Vandemeulebrouck, J.; Poussielgue, N.; Tabbagh, J.; Punongbayan, R. Radon anomaly in the soil of Taal volcano, the Philippines: A likely precursor of the M 7.1 Mindoro earthquake (1994). Geophysical Research Letters. 2003, 30 (9): 34. Bibcode:2003GeoRL..30i..34R. doi:10.1029/2003GL016902.
^ Expert: Earthquakes Hard To Predict. [2009-05-05].
^ EARTH Magazine: Earthquake prediction: Gone and back again.
^ Radon and Naturally Occurring Radioactive Materials (NORM) associated with Hot Rock Geothermal Systems (PDF). Government of South Australia—Primary Industries and Resources SA. [2013-07-16]. (原始内容 (PDF)存档于2012年4月2日).
^ Dawson, J A T. Radon. Its Properties and Preparation for Industrial Radiography. Journal of Scientific Instruments. 1946, 23 (7): 138. Bibcode:1946JScI...23..138D. doi:10.1088/0950-7671/23/7/301.
^ Morrison, A. Use of radon for industrial radiography. Canadian Journal of Research. 1945, 23f (6): 413–419. doi:10.1139/cjr45f-044.
^ Known and Probable Carcinogens. American Cancer Society. [2008-06-26]. (原始内容存档于2003-12-13).
^ Mould, Richard Francis. A Century of X-rays and Radioactivity in Medicine. CRC Press. 1993. ISBN 0-7503-0224-0.
^ Uranium Miners' Cancer. Time. 1960-12-26 [2008-06-26]. ISSN 0040-781X.
^ Tirmarche M; Laurier D; Mitton N & Gelas JM. Lung Cancer Risk Associated with Low Chronic Radon Exposure: Results from the French Uranium Miners Cohort and the European Project (PDF). [2009-07-07].
^ Roscoe, R. J.; Steenland, K.; Halperin, W. E.; Beaumont, J. J.; Waxweiler, R. J. Lung cancer mortality among nonsmoking uranium miners exposed to radon daughters. Journal of the American Medical Association. 1989-08-04, 262 (5): 629–33. PMID 2746814. doi:10.1001/jama.1989.03430050045024.
^ Woodward, Alistair; Roder, David; McMichael, Anthony J.; Crouch, Philip; Mylvaganam, Arul. Radon Daughter Exposures at the Radium Hill Uranium Mine and Lung Cancer Rates among Former Workers, 1952-87. Cancer Causes & Control (Springer). 1991-07-01, 2 (4) [2015-05-01].
^ Uranium mine radon gas proves health danger (1952) - on Newspapers.com. Newspapers.com. [2015-12-22].
^ Radon gas mine health benefits advertisement (1953) - on Newspapers.com. Newspapers.com. [2015-12-22].
^ Clipping from The Montana Standard on Newspapers.com. Newspapers.com. [2015-12-22].
^ Government bans Boulder mine ads about radon health benefits (1975) - on Newspapers.com. Newspapers.com. [2015-12-22].
^ 116.0116.1116.2 Darby, S; Hill, D; Doll, R. Radon: a likely carcinogen at all exposures. Annals of Oncology. 2005, 12 (10): 1341–51. PMID 11762803. doi:10.1023/A:1012518223463.
^ UNSCEAR 2006 Report Vol. I. United Nations Scientific Committee on the Effects of Atomic Radiation UNSCEAR 2006 Report to the General Assembly, with scientific annexes.
^ Rericha, V.; Kulich, M.; Rericha, R.; Shore, D. L.; Sandler, D. P. Incidence of leukemia, lymphoma, and multiple myeloma in Czech uranium miners: a case-cohort study. Environmental Health Perspectives. 2007, 114 (6): 818–22. PMC 1480508. PMID 16759978. doi:10.1289/ehp.8476.
^ Reducing Environmental Cancer Risk – What We Can Do Now. US Department of Health and Human Services. 2008–2009 Annual Report
^ Cohen BL. A test of the linear-no threshold theory of radiation carcinogenesis. Environ. Res. 1990, 53 (2): 193–220. Bibcode:1990ER.....53..193C. PMID 2253600. doi:10.1016/S0013-9351(05)80119-7.
^ Heath CW, Bond PD, Hoel DG, Meinhold CB. Residential radon exposure and lung cancer risk: commentary on Cohen's county-based study. Health Phys. 2004, 87 (6): 647–55; discussion 656–8. PMID 15545771. doi:10.1097/01.HP.0000138588.59022.40.
^ Ionizing Radiation, Part 2: Some Internally Deposited Radionuclides (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 78. World Health Organization, International Agency for Research on Cancer. 2001.
^ Health Risks. EPA. [2008-06-26].
^ Catelinois O; Rogel A; Laurier D; Billon, Solenne; Hemon, Denis; Verger, Pierre; Tirmarche, Margot. Lung cancer attributable to indoor radon exposure in france: impact of the risk models and uncertainty analysis. Environ. Health Perspect. 2006, 114 (9): 1361–6. PMC 1570096. PMID 16966089. doi:10.1289/ehp.9070.
^ WHO Handbook on Indoor Radon. World Health Organization
^ Radon Levels in Dwellings: Fact Sheet 4.6 (PDF). European Environment and Health Information System. December 2009 [2013-07-16].
^ HPA issues new advice on radon. UK Health Protection Agency. July 2010 [2010-08-13].
^ 128.0128.1 Darby, S; Hill, D; Auvinen, A; Barros-Dios, JM; Baysson, H; Bochicchio, F; Deo, H; Falk, R; Forastiere, F; 等. Radon in homes and risk of lung cancer: collaborative analysis of individual data from 13 European case-control studies. BMJ. 2005, 330 (7485): 223. PMC 546066. PMID 15613366. doi:10.1136/bmj.38308.477650.63.
^ President's Cancer Panel, Environmental Factors in Cancer: Radon, December 4, 2008. 互联网档案馆的存檔,存档日期2013年8月29日,.
^ Replies to Radon in homes and risk of lung cancer: collaborative analysis of individual data from 13 European case-control studies. Bmj.com. Retrieved on 2012-04-14.
^ Kaufman, EL; Jacobson, JS; Hershman, DL; Desai, M; Neugut, AI. Effect of breast cancer radiotherapy and cigarette smoking on risk of second primary lung cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2008, 26 (3): 392–8. PMID 18202415. doi:10.1200/JCO.2007.13.3033.
^ Dauer, L. T.; Brooks, A. L.; Hoel, D. G.; Morgan, W. F.; Stram, D.; Tran, P. Review and evaluation of updated research on the health effects associated with low-dose ionising radiation. Radiation Protection Dosimetry. 2010, 140 (2): 103–36. PMID 20413418. doi:10.1093/rpd/ncq141.
^ Lagarde, F; Axelsson, G; Damber, L; Mellander, H; Nyberg, F; Pershagen, G. Residential radon and lung cancer among never-smokers in Sweden. Epidemiology (Cambridge, Mass.). 2001, 12 (4): 396–404. JSTOR 3703373. PMID 11416777. doi:10.1097/00001648-200107000-00009.
^ Risk Assessment of Radon in Drinking Water. Nap.edu (2003-06-01). Retrieved on 2011-08-20.
^ Basic Information about Radon in Drinking Water. [2013-07-24].
^ Godish, Thad. Indoor Environmental Quality. CRC Press. 2001. ISBN 1-56670-402-2.
^ World Health Organization. Radon and cancer, fact sheet 291.
^ 138.0138.1 Consumer's Guide to Radon Reduction: How to fix your home. EPA. [2010-04-03].
^ Building Radon Out: A Step-by-Step Guide On How To Build Radon-Resistant Homes. DIANE Publishing. : 46. ISBN 1-4289-0070-5.
外部連結
维基共享资源中相关的多媒体资源:氡 |
| 查询維基詞典中的氡。 |
維基學院中的相關研究或學習資源: |
(英文)美國環保局有關氡氣的網頁:Radon、radon publications
(英文)National Radon Program Services,堪薩斯州立大學
(英文)英國健康保護局有關氡氣的信息
(英文)Frequently Asked Questions About Radon(有關氡氣的常見疑問),國家安全委員會
(英文)Radon,The Periodic Table of Videos(諾丁漢大學)
(英文)美國肺科協會有關氡氣和肺健康的信息
(英文)加拿大肺科協會:氡氣對健康的影響
(英文)英格蘭和威爾斯的氡氣濃度分佈圖
(英文)UNSCEAR 2000 Report to the General Assembly(2000年聯合國原子輻射效應科學委員會對聯合國大會的報告),含科學附件:Annex B: Exposures from natural radiation sources(附件B:自然輻射源暴露量)
元素周期表(稀有气体) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
|