四氯化碳
| 四氯化碳 | |||
|---|---|---|---|
| |||
 | |||
IUPAC名 Carbon tetrachloride Tetrachloromethane | |||
| 别名 | 四氯甲烷、氯烷、海龍104 | ||
| 识别 | |||
CAS号 | 56-23-5 | ||
PubChem | 5943 | ||
ChemSpider | 5730 | ||
SMILES |
| ||
InChI |
| ||
InChIKey | VZGDMQKNWNREIO-UHFFFAOYAV | ||
UN编号 | 1846 | ||
EINECS | 200-262-8 | ||
ChEBI | 27385 | ||
RTECS | FG4900000 | ||
KEGG | C07561 | ||
| 性质 | |||
化学式 | CCl4 | ||
摩尔质量 | 153.82 g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
密度 | 1.5842 g/cm3 (液) 1.831 g.cm-3, -186 °C (固) | ||
熔点 | -22.92 °C (250 K) | ||
沸点 | 76.72 °C (350 K) | ||
溶解性(水) | 0.8 g/L, 25 °C | ||
log P | 2.64 | ||
蒸氣壓 | 11.94 kPa, 20 °C | ||
kH | 365 kJ.mol-1 (24.8°C) | ||
| 结构 | |||
晶体结构 | 單斜 | ||
分子构型 | 正四面體 | ||
| 危险性 | |||
欧盟危险性符号  有毒 T 有毒 T 危害环境N 危害环境N | |||
警示术语 | R:R23/24/25-R40-R48/23-R59-R52/53 | ||
安全术语 | S:S1/2-S23-S36/37-S45-S59-S61 | ||
NFPA 704 |  0 3 0 | ||
闪点 | 不可燃 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
四氯化碳(化學式:CCl4),也稱四氯甲烷或氯烷,常態下為無色液體。過去常用作滅火器中的滅火物質,也曾經是常用的冷卻劑。
可与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶。在氯代甲烷中,毒性最强。
目录
1 制取
2 性质
3 历史
4 用途
5 替代品
6 分布
7 危害性
7.1 应急处理方法
7.2 中毒临床表现
7.3 治疗
8 参见
9 外部連結
10 参考资料
制取
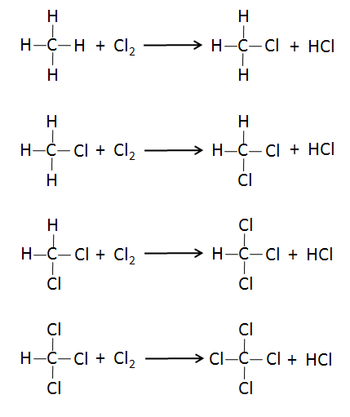
甲烷和氯氣在光照的條件下會發生取代反應,其最終產物就是四氯化碳。反應方程式如下:
性质
四氯化碳是一种无色透明的挥发性液体,具有特殊的芳香气味,味甜。与乙醇、乙醚、氯仿、苯、二硫化碳、石油醚和多数挥發油等混溶。
在四氯化碳分子中,4个氯原子是由共价键以正四面体的结构分布碳原子的四周。因为其结构对称,所以四氯化碳呈非极性,化学反应性呈惰性。甲烷也具有相同的结构,使四氯化碳成为卤代甲烷。作为一种有机溶剂,它非常容易溶解其它非极性化合物,例如脂肪和油。它也能溶解碘。它在常温下稳定,但是在高温下会水解并放出光气(COCl2):
- CCl4+H2O→COCl2+2HCl
在五氯化锑催化剂存在下,四氯化碳会与氟化氢反应,可以生成氟氯甲烷,如一氟三氯甲烷、二氟二氯甲烷,即氟利昂制冷剂。
- CCl4+HF→CCl3F+HCl
- CCl4+2HF→CCl2F2+2HCl
在高温下(> 200°C)与硫反应生成二硫化碳。
- CCl4+6S→CS2+2S2Cl2
在无水氯化铝催化作用下,四氯化碳与苯反应,生成三苯基甲烷。
在铁或铁盐的催化作用下,加热至330℃能促使四氯化碳氧化分解,生成光气。
- 2CCl4+O2→2COCl2+2Cl2
在加热条件下,四氯化碳能与卤盐反应,生成其他四卤化物,如四氯化碳与氟化银、溴化铝或碘化铝反应,分别生成四氟化碳、四溴化碳或四碘化碳:
- 4AgF+CCl4→CF4+4AgCl
- 4AlBr3+3CCl4→3CBr4+4AlCl3
- 4AlI3+3CCl4→3CI4+4AlCl3
在微量氯化氢存在下,四氯化碳与高氯酸银作用,产生具有爆炸性的化合物Cl3CClO4。
- CCl4+AgClO4→Cl3CClO4+AgCl[1]
固态四氯化碳有2种晶体:其中一种是在低于-47.5℃(225.6 K)时所形成的晶体II(crystalline II),另一种是在高于-47.5℃时所形成的晶体I(crystalline II)[2]。
在-47.3℃下它具有单斜晶系结构,空间群为C2 / c,晶格常数a=20.3,B =11.6,C =19.9(.10-1nm),β=111°。其密度比水大,是一种致密的非水相液体[3]
历史
四氯化碳最初是由法国化学家亨利·维克托·勒尼奥在1839年用氯仿与氯反应合成[4],但现在它主要由甲烷产生:
- CH4+4Cl2→CCl4+4HCl
经常使用其他氯反应的副产物作为原料,例如利用二氯甲烷和氯仿:
- C2Cl6+Cl2→2CCl4
在此之前,20世纪50年代,四氯化碳是在105至130℃的温度下由氯化二硫化碳制得的:[5]
- CS2+3Cl2→CCl4+ S2Cl2
由于环境问题以及使用四氯化碳作为原料的氟氯化碳(CFCl)的需求下降,使得四氯化碳的产量自1980年代以来急剧下降。 截止1992年,在美国欧洲日本的产量大约为72万吨。[5]
用途
- 主要用作生产氟利昂F11和F12的原料,用作灭火剂、有机物氯化剂、香料浸出剂、干洗去污剂、谷物熏蒸剂等。
- 可用作药物的萃取剂、织物的干洗剂。
- 也可用来合成氟里昂、尼龙7、尼龙9的单体
- 可制三氯甲烷和药物;金属切削中用作润滑剂。
- 分析中用作脂肪、树脂、树胶等不燃性溶剂。提取带色的各种金属和某些络合物的二苯硫代偶氮肼羰化合物。
- 检定硼、溴、钙、铜、碘和镍。测定硼、溴、氯、钼、磷、银、钨和钒。香花和种子的油质浸出剂。有机微量分析测定氯的标准。电子工业清洗剂。
替代品
由於四氯化碳是一種可致癌的有機化學物,而且會破壞臭氧層,現今用於清潔的四氯化碳大多數都已被三氯乙烯所取代。
分布
四氯化碳广泛存在于大气。河水、海水、海藻和海洋表层沉积物中,在海水中的浓度一般为ppb级。红藻中的四氯化碳估计为生物自身所合成。南北两半球大气中四氯化碳的含量很接近,而且比按生产量估算出的进入环境的数量为高,这与大气中氯与甲烷的作用有关。工业生产的四氯化碳主要通过海-空界面进入海洋,估计大气→海洋通量为1.4×1010克/年,相当于大气中四氯化碳总量的30%。四氯化碳可作为水团混合过程的示踪物。[1]
危害性
| 毒性分级 | 中毒 |
| 急性毒性 | 口服-大鼠 LD50: 2350 mg/kg;口服-小鼠 LD50:8263 mg/kg |
| 刺激数据 | 皮肤-兔子 500 mg/24h 轻度;眼睛-兔子500 mg/24h 轻度 |
| 允许接触限 | 中国25mg/m3;美国0.005mg/L[6] |
应急处理方法
- 迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
- ⑴四氯化碳为无色液体,发生于地面上的污染事故紧急处理方法同三氯甲烷:
- ①迅速用土、沙子或其它可以取到的材料筑成坝以阻止液体的流动,特别要防止其流入附近的水体中,用土壤将其覆盖并将其吸收。也可以在其流动的下方向挖一坑,将其收集在坑内以防四处扩散,然后将液体收集到合适的容器中。
- ②在处理过程中不要用铁器(如铁勺、铁容器、铁铲等),应改用其它工具,因为铁有助于四氯甲烷分解生成毒性更大的光气。有条件的话,操作人员在处理过程中应戴上防毒面具,或其它防护设备。
- ③将受污染的土壤清除剥离后集中进行处理,有以下几种方法可视情况选用:
- a.加热土壤并加水,使四氯甲烷生成甲酸、一氧化碳和盐酸;
- b.将浓碱液加入到土壤中使其与四氯甲烷反应生成一氧化碳;
- c.将稀的氢氧化钠或氢氧化钾加入土壤中,使其与四氯甲烷反应生成甲酸钠或甲酸钾;
- 以上操作应避免在光照条件下进行。
- d.对土壤进行焚烧处理,要保证完全燃烧,以防止光气产生。
- ⑵由于四氯化碳在环境中很稳定,故三氯甲烷的一些处置技术均不适用于它,只可利用其易挥发的特点进行自然或人工强制性挥发至大气中。当有大量气态四氯化碳挥发弥散时,应疏散污染源下风向的人群,以防中毒。
- ⑶水体中受到污染时的处理处置技术同三氯甲烷:当四氯甲烷液体进入水体后,应设法阻断受污染水域与其它水域的通道,其方法为筑坝使其停止流动;开沟使其流向另一水体(如排污渠)等等。由于四氯甲烷属挥发性卤代烃类,对受其污染的水体最为简便易行处理方法是使用曝气(包括深进曝气)法,使其迅速从水体中逸散到大气中。另外,处理土壤的几种方法也可酌情使用。
- ⑴四氯化碳为无色液体,发生于地面上的污染事故紧急处理方法同三氯甲烷:
废弃物处置方法:用焚烧法。废料同其它燃料混合后焚烧,燃烧要充分,防止生成光气。焚烧炉排气中的卤化氢通过酸洗涤器除去。此外,还应考虑用蒸馏法提纯并回收四氯化碳。[1]
中毒临床表现
人體对四氯化碳毒性易感性差别很大。吸入高浓度的四氯化碳蒸气后,可迅速出现昏迷、抽搐等急性中毒症状,并可引发肺水肿、呼吸麻痹。稍高浓度吸入,有精神抑制、神志模糊、恶心、呕吐、腹痛、腹泻。中毒第2至4天呈现肝、肾损害征象。严重时出现腹水、急性肝坏死和肾功能衰竭。少数可有心肌损害、心房颤动、心室早搏。经口服中毒,肝脏症状明显。慢性中毒表现为神经衰弱症候群及胃肠功能紊乱,少数可有肝肿大及肝功异常,肾功能损害罕见,视神经炎及周围神经炎也为数很少。[1]
治疗
主要对神经系统及肝肾损害对症处理。口服中毒洗胃时,可先用液体石蜡或植物油溶解毒物,并严防吸入呼吸道。忌用肾上腺素及含乙醇的药物,以防诱发室性颤动和病症加重。尤其要注意防治肝、肾功能衰竭。出现肾功能衰竭时,可作血液透析或腹膜透析治疗。[1]
- 检查项目
- 肝功能检查 :血清ALT、AST活性升高明显,可作为四氯化碳中毒急性期肝功能损害的主要诊断指标。血清肝胆酸、血清前白蛋白等测定亦为敏感指标。严重受损时,血清胆红素、凝血酶原时间明显升高,而血清白蛋白明显降低。
- 尿常规及肾功能检查 :尿液成分的改变可能是肾功能损害的早期证据。血尿素氮、肌酐增高、内生肌酐清除率降低是测定肾小球滤过率(GFR)常用而敏感的方法。GFR下降超过50%者可考虑急性肾功能衰竭的诊断。
- 血及呼出气中四氯化碳浓度测定,可作为诊断参考。[1]
参见
- 氯甲烷
- 二氯甲烷
- 三氯甲烷
外部連結
- 国际化学品安全卡0024
- ChemSub Online: 四氯化碳
参考资料
^ 1.01.11.21.31.41.5 CCl4的性质. [unknow]. 请检查|access-date=中的日期值 (帮助)
^ Carbon tetrachloride Carbon tetrachloride 请检查|url=值 (帮助). [unknow]. 请检查|access-date=中的日期值 (帮助)
^ F. Brezina, J. Mollin, R. Pastorek, Z. Sindelar. Chemicke tabulky anorganickych sloucenin (Chemical tables of inorganic compounds). SNTL, 1986.
^ V. Regnault (1839) "Sur les chlorures de carbone CCl et CCl2 " (On the chlorides of carbon CCl and CCl2 ), Annales de Chimie et de Physique, vol. 70, pages 104-107. Reprinted in German as: V. Regnault (1839). "Ueber die Chlorverbindungen des Kohlenstoffs, C2Cl2 und CCl2 (On the chlorine compounds of carbon, C2Cl2 und CCl2)". Annalen der Pharmacie 30 (3): 350–352. doi:10.1002/jlac.18390300310.
^ 5.05.1 Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Jaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, “Chlorinated Hydrocarbons” in Ullmann's Encyclopedia of Industrial Chemistry, 2006 Wiley-VCH, Weinheim.doi:10.1002/14356007.a06_233.pub2
^ 周公度. 《化学辞典》. 北京: 化学工业出版社. 2004. ISBN 7-5025-4409-7.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||
| ||||||||||||||
|