铋
| 本元素尚未参照元素專題之格式編寫。 |
body.skin-minerva .mw-parser-output table.infobox captiontext-align:center
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色光泽  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 铋(bismuth)·Bi·83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 贫金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 15 ·6·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 208.98040(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [Xe] 4f14 5d10 6s2 6p3 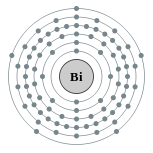 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 克劳德·弗朗索瓦·若弗鲁瓦(1753年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 9.78 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熔點時液體密度 | 10.05 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 544.7 K,271.5 °C,520.7 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 1837 K,1564 °C,2847 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 11.30 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 179 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 25.52 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 5, 4, 3, 2, 1, −1, −2, −3 ((a mildly acidic oxide)) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.02(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:703 kJ·mol−1 (更多) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 156 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 148±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 207 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 三方[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)1.29 µΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 7.97 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)13.4 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
聲速(細棒) | (20 °C)1790 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 32 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 12 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 31 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 2.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 70–95 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-69-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:铋的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
铋(Bismuth)是一种化学元素,它的化学符号是Bi,它的原子序数是83,是有银白色光泽的金属。
铋的化学性质与砷及锑类似。铋是最反磁性(又稱抗磁性)的金属,亦是除汞以外有最低热导率的金属。铋还拥有最高的霍尔系数 ,它具有较高的电阻 。当铋以極薄的层在物体表面沉积时具有半导体的性质,尽管铋是一个后过渡金属。可用于制备易熔合金及与锡融合防止锡疫。
鉍是一種脆性金屬,在自然界中,常以單質形式出現。鉍晶體的表面有時會呈現出不同顏色的色調,這是由於鉍晶體在空氣中氧化時形成的氧化層厚度不一,導致不同波長的光受到不同程度的反射,因此呈現出彩虹的顏色。
以前鉍被認爲是最重的穩定元素,然而在2003年時发现,铋唯一的天然同位素铋209可經α衰變變爲鉈-205[2]。其半衰期為1.9×1019年左右,達到宇宙年龄的10億倍。所以,铋被认为是質量最大的穩定元素。
與其他重金屬不同的是,铋的毒性與鉛或銻相比是相對的較低。铋不容易被身體吸收、不致癌、不損害DNA構造、可透過排尿帶出體外。基於這些原因,鉍經常被用於取代鉛的應用上(目前约铋产量的三分之一)。例如用於無鉛子彈,無鉛銲錫、藥物和化妝品上,特别是水杨酸铋,用来治疗腹泻。而铋的化合物的产量约占铋总产量的一半。
目录
1 金属冶炼
2 化学性质
3 储量
4 參見
5 参考资料
金属冶炼

化学元素铋的合成晶体,表面是非常薄并闪光的氧化层。
工业上将冶炼铋主要是通过氧化铋的氧化还原反应,冶炼炉中的反应方程式主要为:
- Bi2O3+3C→2Bi+3CO↑
- Bi2O3+3CO→2Bi+3CO2
其中,产生的一氧化碳还可能把杂质金属的氧化物还原:
- PbO+CO→Pb+CO2
这些杂质溶于金属铋中组成还原熔炼产物粗铋。如果铋矿中还含有铜,则通常加入黄铁矿来回收铜:
- 2Cu+FeS2→Cu2S+FeS
硫化铋矿可以加入铁屑来冶炼铋,主要的反应方程式是:
- Bi2S3+3Fe→2Bi+3FeS
同样,有部分杂质熔入金属铋得到粗铋。
氧化铋和硫化铋的混合矿则可以通过混合熔炼法来冶炼金属铋,冶炼过程是根据氧化铋和硫化铋彼此之间的氧化还原反应:
- Bi2S3+2Bi2O3→6Bi+3SO2↑。
湿法冶炼铋常用氯化铁-盐酸法和铁粉置换法。氯化铁-盐酸法是将硫化铋矿溶解在三氯化铁和盐酸(HCl)的混合溶液中:
- Bi2S3+6FeCl3→2BiCl3+6FeCl2+3S
其中,FeCl3还能溶解铋矿中的天然铋:
- 3FeCl3+Bi→BiCl3+3FeCl2
矿中如果有氧化铋则直接被盐酸溶解:
- Bi2O3+6HCl→2BiCl3+3H2O。
盐酸的另外一个作用是防止生成的BiCl3水解成不溶性的BiOCl沉淀。铁粉置换法则是把生成的氯化铋中的铋置换出来:
- 3Fe+2BiCl3→2Bi+3FeCl2。
这时沉淀出来的铋为海绵状的。海绵铋如果直接在空气中加热会导致氧化,因此工业上熔融铋是在熔融的氢氧化钠中进行的,这样既可以防止铋的氧化,又可以让生成的液态铋下沉易于聚集,铋中的氧化物及杂质能被氢氧化钠溶解。[3]
化学性质

鉍
铋的化学性质和砷、锑相似,常温下不与水及氧作用,因此,铋在空气中稳定。在加热至熔点时,铋表面逐渐生成灰黑色的氧化物。金属铋可以在一定条件下和卤素直接反应生成三卤化铋。高温下,金属铋能和很多非金属及金属生成三价铋的化合物,铋的还原电势为正值,即在电动序中位于氢后,所以铋不和非氧化性酸反应。铋能溶于热的浓硫酸中,也能顺利地和硝酸反应。与砷、锑不同,铋有生成含氧酸盐的明显趋势,如硫酸铋、硝酸铋、砷酸铋等。铋不和碱反应。
需要指出的是,铋与氧化剂作用时通常只生成3价铋而不是5价铋。+5氧化态的铋远不如砷(V)以及锑(V)稳定。这不仅仅是因为铋的第IV电离能及第V电离能之和(9.776mJ·mol-1),而且还因为6s2的一个电子激发到6d空轨道需要很大的能量,所以由低氧化态的铋生成Bi(V)的化合物是很艰难的。[4]
此外,铋还能形成原子簇化合物。
铋唯一的天然同位素铋是铋209,在传统上也被视为最重的稳定同位素,但它长期以来一直怀疑是不稳定的。在2003年最终表明,当研究人员在法国的l'Institut d'Astrophysique Spatiale d'Orsay,测得铋209的半衰期为1.9×1019 年s ,相当于十亿倍于现在宇宙年龄。由于其特别长的半衰期,为所有目前已知的医疗和工业应用,铋可以被视为稳定的非放射性。而对它的放射性是纯粹是学术兴趣,因为铋是少数几个元素,它的放射性首先在理论上被怀疑而不会在实验室中被发现。铋具有最长已知α衰变半衰期,虽然碲-128具有双重β衰变以上的半衰期 2.2×1024 年s .
具有短半衰期的几种同位素也已被发现,可以衰变为锕,镭和钍。铋213还被发现衰变成铀233。
在商业上,放射性同位素铋-213可以通过一个子直线粒子加速器轰击产生镭用制造辐射。在1997年,抗体结合物与铋213,其具有45分钟的半衰期和衰变与α粒子的排放,被用来治疗患者的白血病。这种同位素也已尝试了在癌症治疗中,例如,在靶向α治疗(TAT)程序。
储量
美国地质调查局2015年公布报告,全球铋金属储量为32万吨,储量基础为68万吨。中国的铋储量居世界第一,储量大约为24万吨,占世界总储量的75%;储量基础约为47万吨,占世界的69%。郴州已探明铋金属储量约占中国73%,全球50%。
2013年中国铋产量7500吨,占世界89%。主要产自铅矿及多金属伴生矿山。
參見
- 氮族元素
- 铋酸钠
参考资料
^ Cucka, P.; Barrett, C. S. The crystal structure of Bi and of solid solutions of Pb, Sn, Sb and Te in Bi. Acta Crystallographica. 1962, 15 (9): 865. doi:10.1107/S0365110X62002297.
^ Dumé, Belle. Bismuth breaks half-life record for alpha decay. Physicsweb. 2003-04-23.
^ 无机化学丛书.第四卷.P472.铋的生产与应用
^ 无机化学丛书.第四卷.P484.铋的化学性质
氮族元素 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||