烯烃

乙烯的3D模型,最简单的烯烃。

乙烯的分子结构,最简单的烯烃。
.mw-parser-output ruby>rt,.mw-parser-output ruby>rtcfont-feature-settings:"ruby"1.mw-parser-output ruby.largefont-size:250%.mw-parser-output ruby.largerfont-size:300%.mw-parser-output ruby.large>rt,.mw-parser-output ruby.large>rtcfont-size:.3em.mw-parser-output ruby.larger>rt,.mw-parser-output ruby.larger>rtcfont-size:.25em
烯(xī)
烴(tīng)[1][2](英语:alkene)是指含有C=C鍵(碳-碳双键)的碳氢化合物[3]。属于不饱和烃,分为链烯烃与环烯烃。按含双键的多少分别称单烯烃、二烯烃等。只拥有一个双键的简单烯烃组成了一个由通式CnH2n(其中 n ≥ 2)代表的同系物[4]。
最简单的烯烃是乙烯(C2H4),國際純化學和應用化學聯合會命名为ethene。乙烯是工业上生产规模最大的有机化合物[5]。
“烯”字是新造字,左边的火取自“碳”字,代表可以燃烧;右边的希取自“稀”字,表示氢原子和化合价稀少之意,意味着烯是烷(完整)烃的一类不饱和衍生物。
目录
1 乙烯的结构
1.1 乙烯的形状
1.2 分子的几何形态
2 物理性质
3 化学性质
4 合成
5 反应
5.1 加成反应
5.1.1 亲电加成
5.1.2 与氢加成
5.1.3 与水加成
5.1.4 与卤素加成
5.1.5 与次卤酸加成
5.1.6 与硫酸加成
5.2 氧化反应
5.3 聚合反应
6 烯烃的命名
6.1 IUPAC名称
6.2 顺反标记
6.3 E/Z标记
6.4 一般名称
7 参考资料
8 参见
9 命名法外部連結
乙烯的结构
乙烯的形状
根据价层电子对互斥理论,乙烯中每一个双键碳原子的键角都約是120°。这个角度会受连接在双键碳原子上的官能团的交互作用产生的范德瓦耳斯力影响。比如,C-C-C 键角在丙烯中为123.9°。烯烃的碳-碳双键键能比单键高,133pm的键长也比单个共价键短。
分子的几何形态
如同单个共价键,双键也能被描述为原子轨道的重叠。与单键不同的是,单键只包含一个σ键,而碳-碳双键包含了一个σ键和一个π键。
每一个双键碳原子利用它本身的三个sp2杂化轨道与三个原子形成σ键,那一个未杂化的"2p"轨道,垂直于由三个sp2杂化轨道形成的平面,重叠形成π键。

顺-2-丁烯

反-2-丁烯
因为需要很多的能量才能破坏一个π键(对于乙烯是264 千焦/摩),所以碳-碳双键间的转动很困难并严重受限。产生的一个结果是取代烯烃存在一个或两个异构体(顺式异构和反式异构)。例如,顺-2-丁烯中的两个甲基取代在双键的同一侧,而反-2-丁烯的在不同的侧面。
双键不可能被扭曲。事实上,一个90°的扭曲需要的能量约等于πdisplaystyle pi 
物理性质
烯烃的物理性质可以与烷烃对比。物理状态决定于分子质量。简单的烯烃中,乙烯、丙烯和丁烯是气体,含有五至十六个碳原子的直链烯烃是液体,更高级的烯烃则是蜡状固体。烯烃為非極性化合物,其唯一的分子間作用力為分散力,因此烯烃不溶於水,但可溶於四氯化碳等有機溶劑。液體烯類之密度小於水,會浮在水面上。
反式烯烃比顺式烯烃的沸点低,熔点高。
化学性质
烯烃的化学性质比较稳定,但比烷烃活泼。考虑到烯烃中的碳-碳双键比烷烃中的碳-碳单键强,所以大部分烯烃的反应都有双键的断开并形成两个新的单键。
合成
- 最常用的工业合成途径是石油的裂解作用。
- 烯烃可以通过酒精的脱水合成。例如,乙醇脱水生成乙烯:
- CH3CH2OH + H2SO4 → CH3CH2OSO3H + H2O → H2C=CH2 + H2SO4
- 其他醇的消去反应都是Chugaev消去反应和Grieco消去反应,产生烯烃。
- 高级α-烯烃的催化合成可以由乙烯和有机金属化合物三乙烯基铝在镍,钴和铂催化的情况下实现。
- 烯烃可以由羰基化合物通过一系列反应合成,比如乙醛和酮。
- 和一个烷基卤化物发生Wittig反应
- 和一个苯基砜发生Julia成烯反应
- 和两个不同的酮发生Barton-Kellogg反应
- 结合一个酮,Bamford-Stevens反应或者Shapiro反应
- 和一个烷基卤化物发生Wittig反应
- 烯烃可以由乙烯基卤化物结合生成。
- 烯烃可以由炔烃的选择性还原合成。
- 烯烃可以由Diels-Alder反应或Ene反应重排制得。
- 烯烃可以由α-氯代砜通过Ramberg-Bäcklund反应合成。
反应
烯烃因为可以广泛参与石化工业的反应,被誉为石化工业的原材料。
加成反应
烯烃能进行很多种加成反应:
亲电加成
大部分的烯烃加成反应是依照亲电加成机理完成的。一个例子就是Prins反应,其中羰基是亲电试剂。
- 与卤化氢HX加成,不对称烯烃加成时遵循马氏规则:
- RCH=CH2 + HX → RCHX-CH3
- 与水加成,遵循马氏规则:
- RCH=CH2 + H2O → RCHOH-CH3
- 与卤素X2反式加成:
- RCH=CH2 + X2 → RCHX-CH2X
- 与次卤酸HOX加成:
- RCH=CH2 + X-OH → RCHOH-CH2X
与氢加成
烯烃经催化氢化可得到相应的烷烃。这种反应需要在高压环境下由金属催化剂参与进行。一般工业催化剂包含了镍、鈀和铂。实验室合成中,Raney镍是常用催化剂。一个例子就是乙烯催化加氢得到乙烷:
- CH2=CH2 + H2 → CH3-CH3
与水加成
烯烃在酸(常用硫酸或磷酸)的催化作用下,与水直接加成生成醇。酸催化下,烯烃的直接水合是亲电加成反应。反应的第一步是酸中的质子加到双键碳原子上,生成碳正离子中间体,这一步是控制反应速率的慢步骤。然后水分子与碳正离子反应,生成质子化的醇。最后质子化的醇失去质子生成醇。不对称烯烃与水的加成也遵循马氏规则。例如:
- CH2=CH2 + HOH → CH3-CH2-OH (H3PO4,280-300℃,7-8MPa)
- CH3-CH=CH2 + HOH → CH3CHOHCH3 (H3PO4,195℃,2MPa)
上述反应工业上生产乙醇和异丙醇等低级醇的一种方法,称为“直接水合法”。除乙烯外,其他烯烃均不生成伯醇。
与卤素加成
烯烃与溴或者氯的加成得到邻二溴或二氯烷烃。溴水的褪色可以作为检验乙烯的测试:
- CH2=CH2 + Br2 → BrCH2-CH2Br
- 以下是此反应机理:
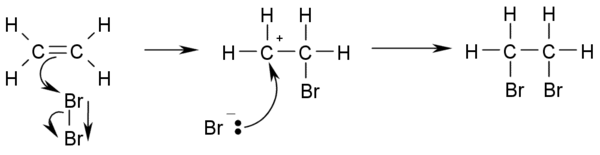
- 此反应之所以能够发生,是因为双键的高电子云密度导致了溴-溴间电子的临时移动产生一个临时的偶极,最终导致靠近双键的溴略显正电性变为亲电试剂。
- 与卤化氢加成:例如HCl或HBr,最终生成相应的卤代烷。
- CH3-CH=CH2 + HBr → CH3-CHBr-CH3
- 如果两个双键碳原子连接的氢原子数量不等,卤素将优先加成在拥有氢较少的碳上(Markovnikov's规则)
- 以下是反应机理:
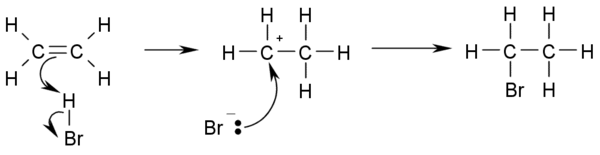
碳烯(卡宾)的加成得到相应的环丙烷衍生物。
与次卤酸加成
烯烃与次卤酸(常用次氯酸或次溴酸)加成生成β-卤代醇。例如:
- CH2=CH2 + HOCl → CH2ClCH2OH
在实际生产中,由于次氯酸不稳定,常用氯和水直接反应。例如,将乙烯和氯气直接通入水中以生产β-氯乙醇。这时反应的第一步是烯烃与氯气进行加成,生成环状氯鎓离子中间体。在第二步反应中,由于大量水的存在,水进攻氯鎓离子生成β-氯乙醇。但溶液中还有氯离子存在,它进攻氯鎓离子,故有副产物1,2-二氯乙烷生成。
不对称烯烃与次卤酸的加成,也遵循马氏规则。亲电试剂的氯加到含氢较多的双键碳原子上,水加到含氢较少的双键碳原子上。例如:
- CH3CH=CH2 + HOCl → CH3CHOHCH2Cl
上述两个反应的产物——氯乙醇和1-氯-2-丙醇是制备环氧乙烷和甘油等化合物的重要化工原料。
与硫酸加成
和烯烃与卤化氢的加成相似,烯烃与硫酸的加成也是离子型的亲核加成。例如,将乙烯通入冷的浓硫酸中,首先质子加到一个双键碳原子上,生成碳正离子中间体,然后硫酸氢负离子与之结合,生成硫酸氢乙酯:
- CH2=CH2 + HOSO2OH → CH3-CH2-OSO2OH
因为硫酸拥有两个活泼氢原子,所以在一定条件下可与两分子乙烯进行加成,生成硫酸二乙酯(中性硫酸酯):
- CH2=CH2 + HOSO2OH + CH2=CH2 → CH3CH2OSO2OCH2CH3
不对称烯烃与硫酸的加成反应,也符合马氏规则。例如(括号内为反应温度及硫酸浓度):
- CH3CH=CH2 + HOSO2OH → CH3CH(OSO2OH)CH3 (50℃,75-85%)
- (CH3)2C=CH2 + HOSO2OH → (CH3)3COSO2OH (10-30℃,50-65%)
上述反应说明,烯烃对反应条件和硫酸浓度的要求,随着烯烃双键碳原子上连接的甲基增多而降低,即烯烃的活性和烯烃与卤素、卤化氢的加成活性相同。
若将C12至C18的直链α-烯烃与硫酸反应,再将生成的酸性硫酸酯用碱中和,则会得到一种硫酸酯盐型阴离子表面活性剂,可作为液体洗涤剂的原料,也可用作纺织助剂:
- R-CH=CH2 + HOSO2OH → R-CH(OSO2OH)CH3
- R-CH(OSO2OH)CH3 + NaOH → R-CH(OSO2ONa)CH3 + H2O
氧化反应
烯烃可以被许多氧化剂所氧化。
- 在有氧气的情况下,烯烃可以燃烧,有明亮火焰,伴随二氧化碳和水的生成。
- 与氧气或羧酸发生催化氧化生成环氧化物。
- 与臭氧发生臭氧化反应导致双键的断裂,得到两个醛或酮
- R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
- 这个反应可以用来测定未知烯烃的双键位置。
乙烯與高錳酸鉀水溶液反應產生二氧化錳,氫氧化鉀及乙二醇
3CH2=CH2+2KMnO4+4H2O→2MnO2+2KOH+3HO-CH2-CH2-OH
聚合反应
烯烃的聚合反应是一个经济意义极高的反应,得到的高聚物有很高的工业价值,例如塑料中的聚乙烯和聚丙烯,合成润滑油中的聚a-烯烃。聚合反应既可以通过自由基机理来实现,又可以通过离子机理来实现。
烯烃的命名
IUPAC名称
根据IUPAC命名规则,为了给烯烃主链命名。英文命名将中缀-an-换为-en-。例如CH3-CH3 是ethane。因此 CH2=CH2的名字是ethene。中文命名是直接将“烷”变为“烯”,例如CH3-CH3是乙烷,因此CH2=CH2的名字是乙烯。
在高级烯烃中,因为双键位置不同而导致异构体的出现,我们运用下面的数字系统:
- 命名含有双键的最长碳链为主链,使得双键碳原子的数字尽可能最小。
- 用第一个双键碳原子指出双键的位置。
- 对照烷烃那样命名取代烯烃或支链。
- 首先是给碳原子标号,按顺序注明取代基团,双键和主链的名字。
1-己烯 Hex-1-ene |
4-甲基-1-己烯 4-Methylhex-1-ene |
4-乙基-2-甲基-1-己烯 4-Ethyl-2-methylhex-1-ene |

Naming substituted hex-1-enes
顺反标记

顺-反异构体的区别
E/Z标记

E和Z异构体的区别
一般名称
尽管IUPAC命名系统有很高的通用性和精确性,但是一些烯烃的一般名称已经被广泛接受。
例如:
| (CH3)2C=CH2 | |
| IUPAC 名稱: | 2-甲基丙烯 |
| 一般名稱: | 異丁烯 |
参考资料
^ 《化學命名原則》,第四版,國立編譯館,2004
^ 中華民國教育部重編國語辭典修訂本 - 烴
^ Wade, L.G. Organic Chemistry 6th. Pearson Prentice Hall. 2006: 279. ISBN 1-4058-5345-X.
^ Moss, G. P.; Smith, P. A. S.; Tavernier, D. Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995). Pure and Applied Chemistry. 1995, 67 (8–9): 1307–1375. doi:10.1351/pac199567081307.
^ Production: Growth is the Norm. Chemical and Engineering News. July 10, 2006, 84 (28): 59. doi:10.1021/cen-v084n034.p059.
参见
- 环烯烃
- 芳香烃
- 二烯烃
- 轴烯
- 轮烯
- 烷烃
- 炔烃
命名法外部連結
.mw-parser-output .refbeginfont-size:90%;margin-bottom:0.5em.mw-parser-output .refbegin-hanging-indents>ullist-style-type:none;margin-left:0.mw-parser-output .refbegin-hanging-indents>ul>li,.mw-parser-output .refbegin-hanging-indents>dl>ddmargin-left:0;padding-left:3.2em;text-indent:-3.2em;list-style:none.mw-parser-output .refbegin-100font-size:100%
- Rule A-3. Unsaturated Compounds and Univalent Radicals [1] IUPAC Blue Book.
- Rule A-4. Bivalent and Multivalent Radicals [2] IUPAC Blue Book.
- Rules A-11.3, A-11.4, A-11.5 Unsaturated monocyclic hydrocarbons and substituents [3] IUPAC Blue Book.
- Rule A-23. Hydrogenated Compounds of Fused Polycyclic Hydrocarbons [4] IUPAC Blue Book.
| ||||||||||||||||||
| ||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
|

